GMP安全性控制策略
ACROBiosystems百普赛斯GMP级别产品参考各国法规要求对整个生产、质控过程中的外源因子污染等安全性进行了整体的设计和考量,充分保证了产品的安全性。我们致力于开发高质量的、应用于细胞与基因疗法临床商业化生产阶段的相关GMP级别原料试剂,结合药物生产规范以更严格的质量管理和放行检测标准为客户提供真正的GMP级别产品!
生产用细胞株来源清晰、可溯源。
对经过驯化、建库后的生产用宿主细胞HEK293进行全面检定(28项),检测机构为国际知名第三方检测机构,符合中美药典和ICH Q5。
宿主细胞经过构建后的工程细胞建库后再次进行检定,检测机构为国内知名第三方检测机构,,符合中美药典和ICH Q5。
上游细胞培养阶段使用的培养基为化学成分明确培养基 (Chemical Defined Medium,CDM),整个上游生产过程中所有物料均为无血清(SerumᅠFree,SF)、无动物源性(Animal Origin Free,AOF)物料。细胞复苏及扩增阶段 敞口操作均在C级洁净区的生物安全柜(Biosafety Cabinet,BSC)中进行,反应器生产阶段使用一次性密闭系统与无菌焊接技术,不同项目之间采用阶段式生产方式,从而极大地降低了发生污染和交叉污染风险。

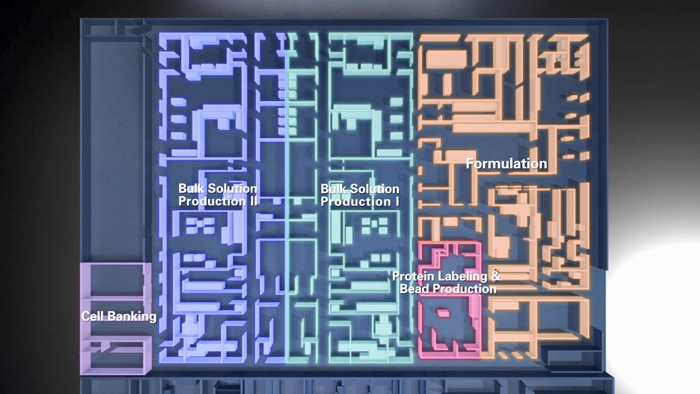




下游纯化工艺中引入低pH和纳滤等病毒去除/灭活步骤,同时对于关键病毒去除步骤进行病毒去除工艺验证。纯化过程使用的层析介质等均为项目专用,且不用于不同的生产阶段,避免交叉污染风险。
制剂生产在严格的B+A生产环境进行:原液经除菌过滤得到半成品后,使用全自动设备以及一次性无菌灌装系统,在B+A无菌环境下进行无菌部件组装、灌装、加塞、自动进出料和冻干等操作(PMS持续环境监测系统),冻干结束后在C+A环境下完成轧盖密封,获得的待包装产品经人工灯检、贴标等操作,并且检验合格后方可成品入库和放行。
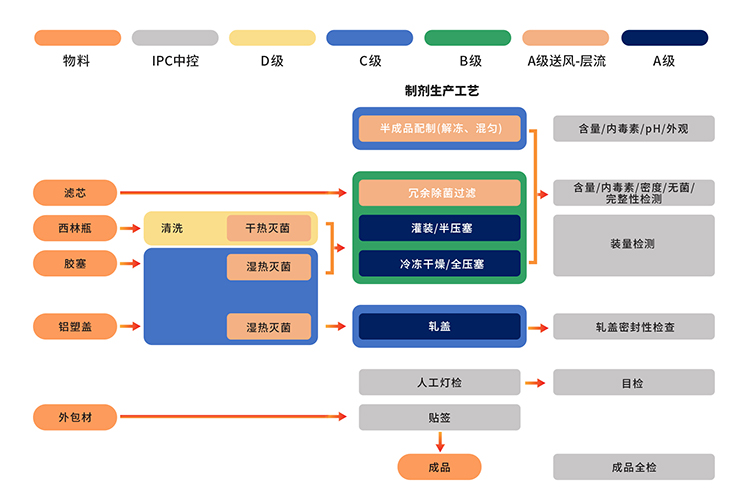
严格的无菌工艺验证及包装密封性验证:无菌生产工艺验证包括使用无菌营养培养基和/或产品替代品的APS(培养基模拟罐装)。APS会评估从工艺所用物料的灭菌和清洁后到容器密封之间进行的所有无菌操作。APS还会考虑正常生产以及最差条件下已知的各种无菌操作和干预措施,是无菌生产工艺非常重要的验证活动。GMP级产品的每种包装组件在首次生产前开展无菌生产工艺验证,并且通过质量风险评估周期性开展再验证。包装密封性也是产品无菌保障和质量可靠性的有效保障,采用微生物侵入法和示踪法进行包装系统的密封性验证,产品长期稳定性研究过程中进行密封性测试,确保无菌可靠性。
生产用原辅料、包材尽量选取在CDE备案的药用级原辅料和包材。对于GMP产品生产用物料均经过研发/生产/质量团队共同评估定级,对于关键物料参考法规及药典的要求制定物料质量标准,进行关键表征分析。

终产品质控放行:
- 外源因子检测:无菌、内毒素、支原体、外源病毒等
- 各种工艺杂质残留检测:抗生素、HCP、HCD等
- 共13~16项QC质检项
- 产品CoA、产品放行单
- 监视和测量设备经过计量,关键分析仪器经过3Q验证
- 分析方法经过全面验证
- 关键分析仪器开通审计追踪
- GMP安全性控制策略
- 更多精彩推荐















