【厚积薄发】全球首款RSV mRNA疫苗终迎开花结实

2024年5月31日,Moderna的mRNA呼吸道合胞病毒疫苗ESVIA(mRNA-1345)获得FDA批准上市,成为全球首款RSV mRNA疫苗。这款疫苗主要用于预防60岁或以上成人RSV相关下呼吸道疾病和急性呼吸疾病。此外,今年6月5日,深信生物宣布其自主研发的全球首款二价呼吸道合胞病毒mRNA疫苗IN006的临床试验申请(IND)获得了中国国家药品监督管理局药品审评中心(CDE)的默示许可。RSV mRNA疫苗在不断摸索中终于收获累累硕果。
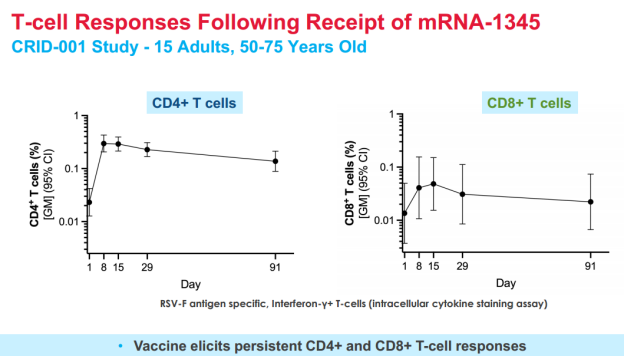
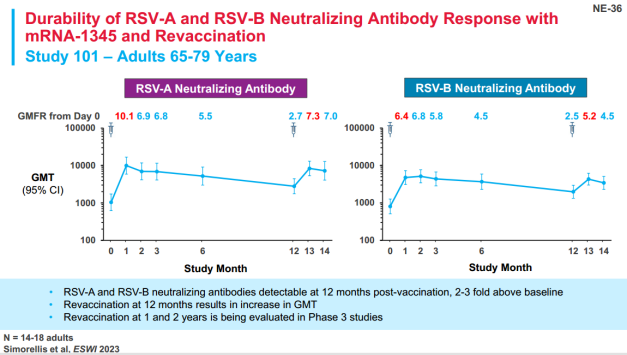
2021年8月3号,Moderna开发的mRNA-1345获得FDA的快速通道;2022年Moderna公布的关于mRNA-1345的Ⅰ期临床数据显示,mRNA-1345在两组人群中均具有良好的耐受性,不同剂量的mRNA-1345(50ug、100ug及200ug)在两组人群中具有相当的免疫原性,相比安慰剂组,均可触发明显的针对RSV-A/B的中和抗体滴度。2023年1月30号,基于良好的Ⅲ期临床数据,FDA授予mRNA-1345突破性疗法认定。2023年7月5号,Moderna已正式向欧洲、瑞士、澳洲及美国的药监局提交营销授权申请(marketing authorization applications)或者生物制剂许可申请(BLA)。2024年5月31日,Moderna的mRNA呼吸道合胞病毒疫苗ESVIA (mRNA-1345)获得FDA批准上市,成为全球首款RSV mRNA疫苗。
Moderna早期评估筛选了有效的RSV抗原,即pre F作为目标抗原,作为mRNA-1345编码序列的来源。非编码序列方面,Moderna在多个专利布局中描述了适用于RSV疫苗的UTR序列,此外,使用与Moderna的新冠疫苗相同的脂质纳米颗粒(LNP)递送,包含优化的蛋白和密码子序列,提高mRNA疫苗的稳定性和有效性。
IN006于2024年1月获得美国食品药品监督管理局(FDA)的IND批准,3月1日,深信生物在Clinicaltrials.gov网站上注册了二价RSV mRNA疫苗的美国一期临床试验:A Study to Describe the Safety and Immunogenicity of a Respiratory Syncytial Virus Vaccine IN006 in Healthy Adults(登记号 NCT06287450)。6月5日,IN006获得CDE的IND批准。IN006是首款获得中国临床试验许可的国产RSV疫苗产品,同时也是首款在国内获批临床的非新冠mRNA预防性疫苗产品。
IN006采用了深信生物自主设计的融合前F蛋白、mRNA元件和LNP递送系统。IN006含有分别编码RSV-A和RSV-B稳定融合前构象F蛋白的mRNA,是同时针对RSV-A和RSV-B两个亚组的二价mRNA疫苗,具有更好的广谱性。
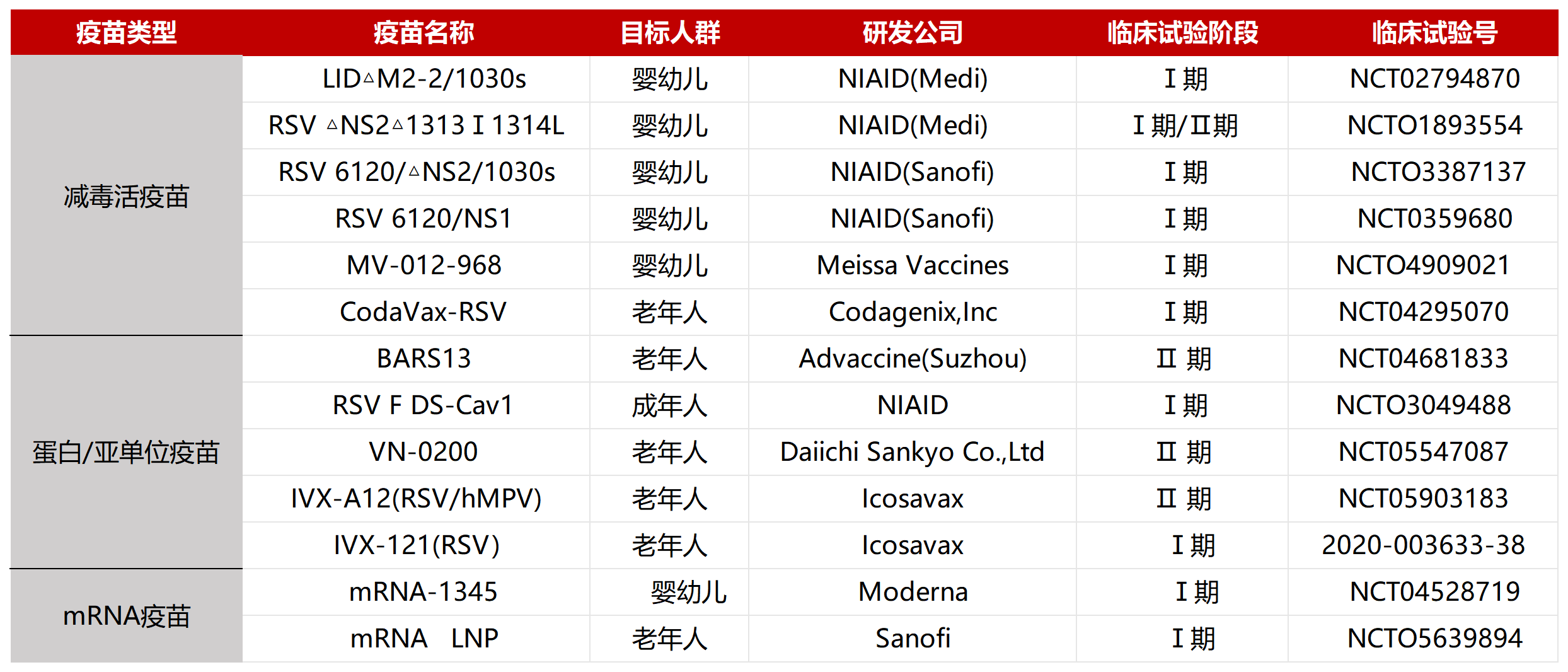
呼吸道合胞病毒是引起急性呼吸道感染的主要病原体之一,给婴幼儿和老年人带来了沉重的疾病负担。自福尔马林灭活呼吸道合胞病毒疫苗失败以来,RSV疫苗研究进展缓慢。但近年随着对RSV F蛋白结构研究的不断深入,RSV的候选疫苗取得了快速进展,种类也逐渐增多,包括RSV mRNA疫苗、重组载体疫苗、亚单位疫苗、病毒样颗粒疫苗、减毒活疫苗和嵌合疫苗等(具体信息见下图)。

-
• 特殊结构设计&高纯度:天然三聚体构象的融合前Pre-F蛋白、融合后Post-F蛋白以及G蛋白;SEC-MALS>90%;
-
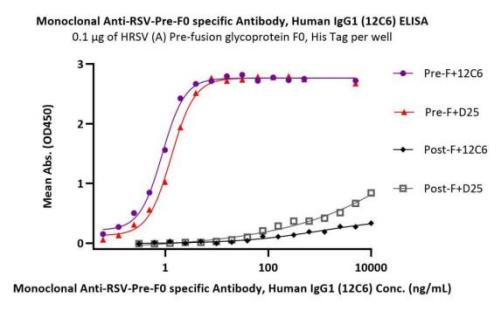
• 高特异性&结合活性:Pre-F/Post-F特异性抗体及RSV-F0广谱抗体,结合活性经ELISA实验验证;
-
• 高精密度&准确度:经Ø、V、I、Ⅳ表位验证Pre-F抗原定量试剂盒;Post-F抗原定量试剂盒;高灵敏Pre-F及Post-F抗体检测试剂盒;
-
• 高灵敏度&特异性:ELISpot细胞因子检测试剂盒;
-
• 高灵活度&一站式服务:ELISA及ELISpot分析方法开发服务。

-
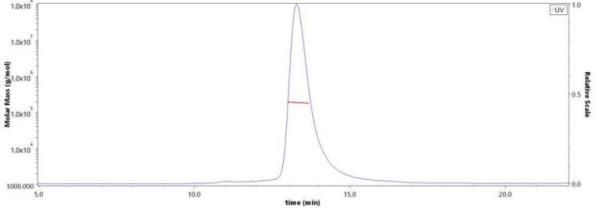
天然三聚体构象Pre-F蛋白验证数据 (Cat. No. RSF-V52H7)

-
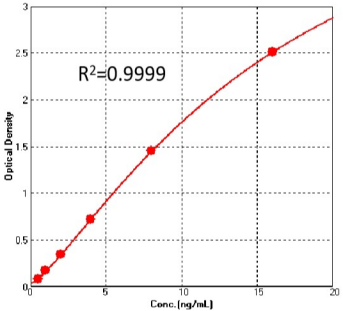
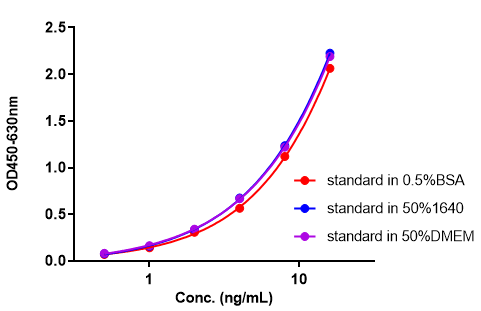
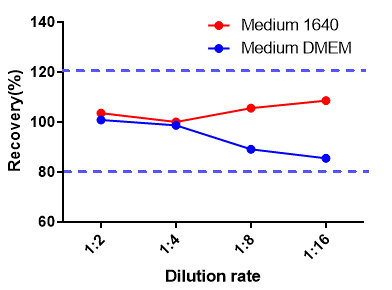
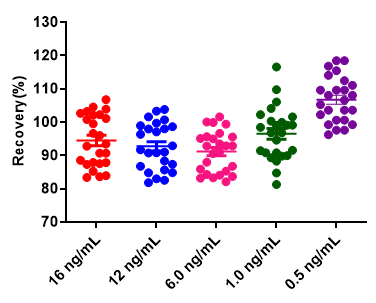
Pre-F抗原定量试剂盒验证数据(Cat. No. RAS-A177)
精密度
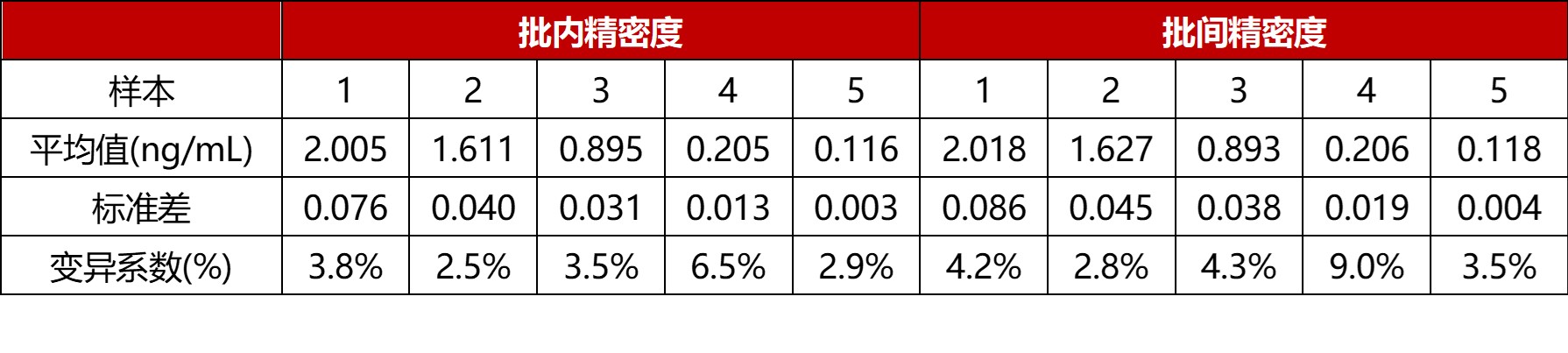
经验证该项目的批内及批间精密度CV≤15%,满足试剂盒申明的标准范围。

下一篇: 一篇带你了解不同种类流感疫苗