【新品上市】ACRO基因敲除细胞株,赋能新药研发
基因敲除细胞株可通过基因编辑技术将特定基因从细胞基因组中完全删除,从而作为重要的研究工具,精准模拟靶点基因缺失的状态,为靶点验证、作用机制研究、药物筛选等关键环节提供更高效、更可靠的解决方案。相比传统方法,基因敲除细胞株大幅提升了实验的精准度、可重复性和效率,加速药物从实验室走向临床。
基因功能研究、靶点验证、药物筛选等一些关键环节直接影响新药的成功率和研发效率,基因敲除细胞株可以在这些方面帮助药物研发者优化研发流程:
药物作用机制研究通常依赖于细胞信号通路分析,但由于生物系统具有补偿机制,某些基因的短期抑制可能不会反映其长期缺失的影响,导致研究结论不准确。基因敲除细胞株能够更真实地模拟基因功能丧失,揭示药物作用的真实生物学背景,同时帮助发现潜在的补偿机制,避免单一靶点抑制导致的耐药性问题。
在药物研发早期,靶点选择错误是导致失败的主要原因之一。传统的RNA干扰(RNAi)等方法只能短暂抑制基因表达,且容易出现脱靶效应,影响实验的准确性。基因敲除细胞株不仅能够稳定敲除的目标基因,提供长期、稳定的基因缺失模型,同时也能避免RNA干扰带来的脱靶效应,模拟靶基因相关疾病模型,以更精确评估靶点在疾病中的作用,降低靶点选择错误的风险。
传统药物筛选方法依赖于细胞增殖抑制实验,但如果药物的靶点并非该细胞赖以生存的核心基因,筛选出的药物可能在后续研究中表现不佳,导致时间和资源浪费。基因敲除细胞株能够构建缺失特定靶点的细胞模型,直接评估药物对靶点的依赖性;可用于正向和反向筛选,确定哪些药物对目标基因缺失的细胞仍然有效,帮助发现潜在的新靶点或耐药机制。
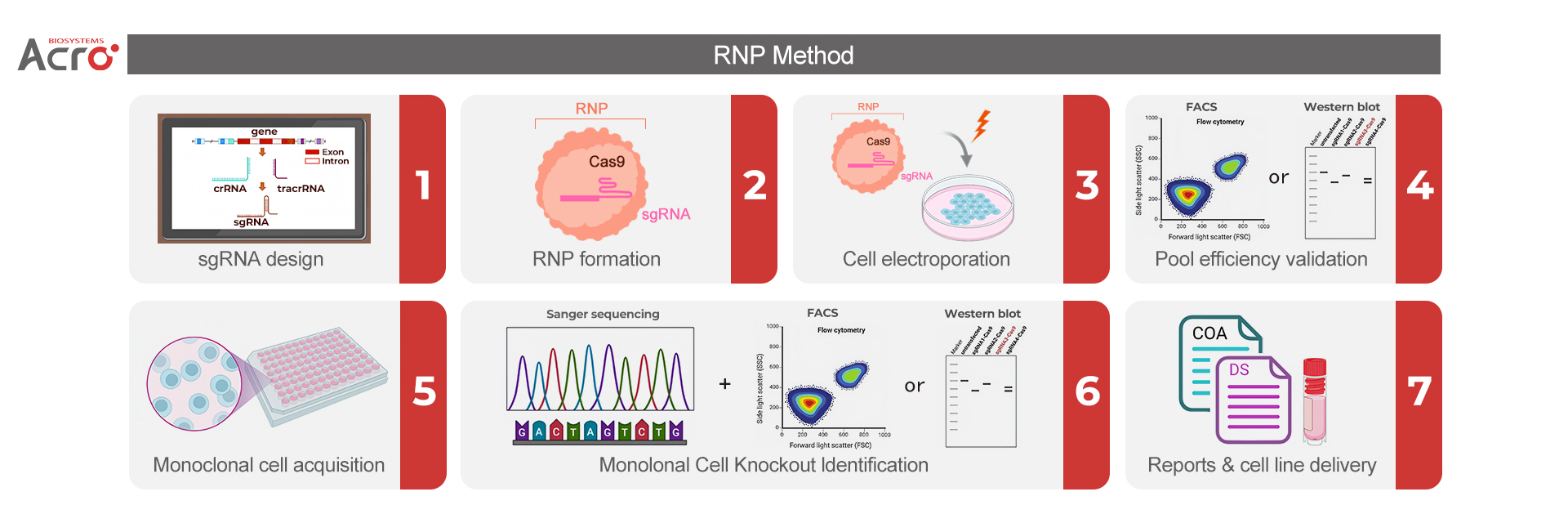
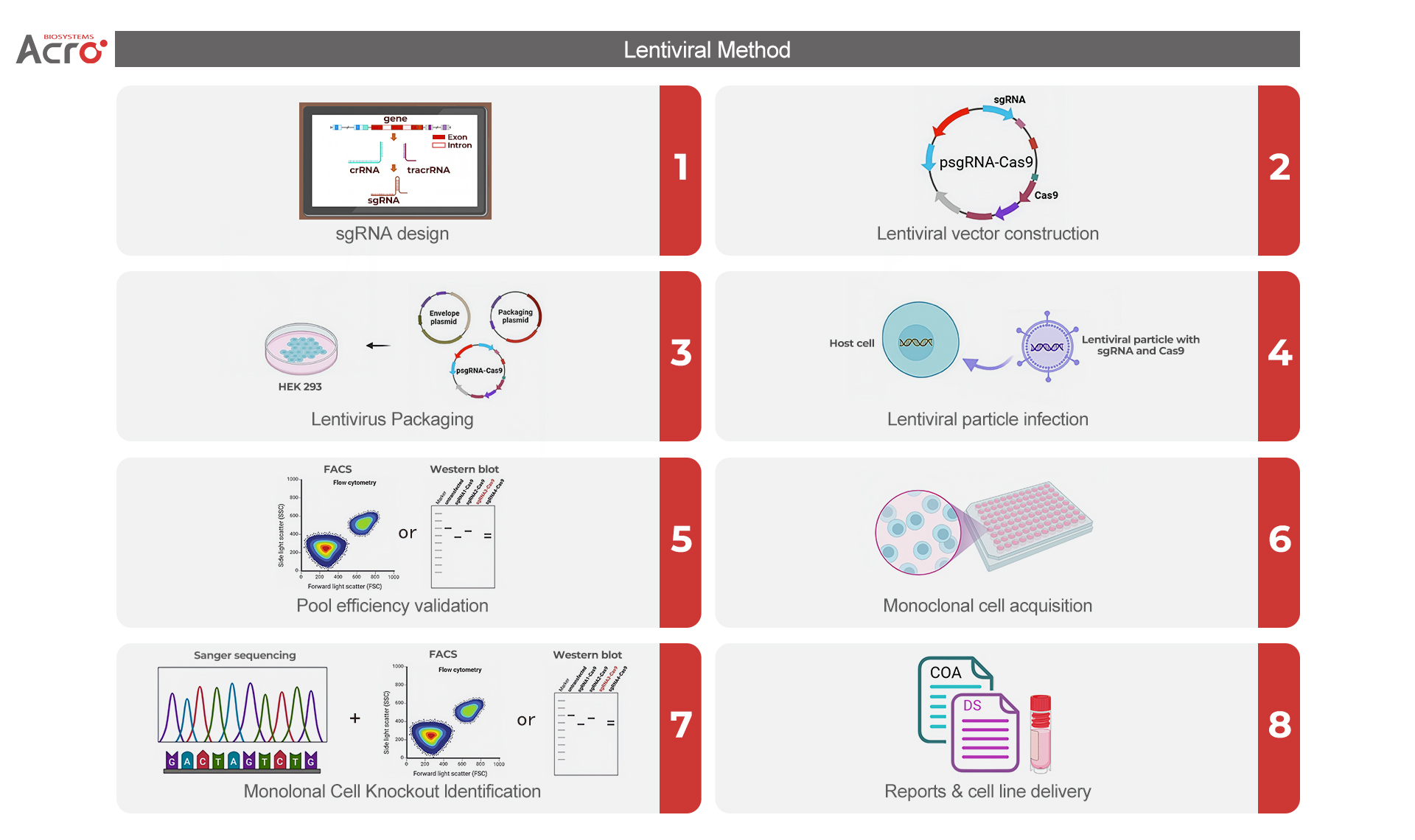
确定靶点后,构建基因敲除细胞株的第一步是设计特异性的sgRNA,引导Cas9核酸酶靶向目标基因的特定位点,Cas9蛋白切割目标DNA,产生双链断裂(DSB)。随后,细胞通过非同源末端连接(NHEJ)修复过程形成插入缺失突变(Indel),从而引入移码突变(reading frame shift),实现在内源基因组层面对目标基因的敲除。RNP(Ribonucleoprotein,核糖核蛋白)法和慢病毒转染法是构建基因敲除细胞株最为常用的两种方案。
-
RNP法直接将Cas9蛋白和sgRNA孵育为复合物,并采用电转染法将RNP导入至靶细胞中。RNP在进入细胞后,短时间内即会发挥基因编辑作用,最后被细胞降解。
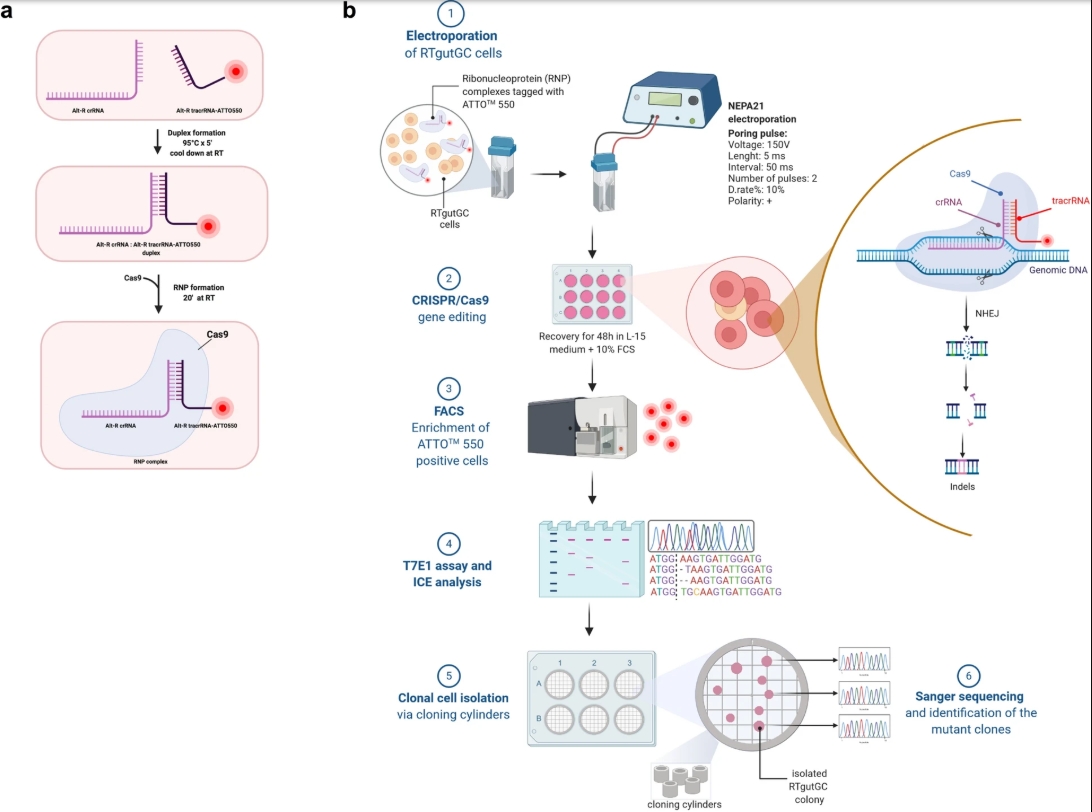
基于CRISPR-Cas9基因编辑技术通过RNP电转法构建基因敲除细胞株[1]
-
慢病毒转染法是利用慢病毒载体将Cas9和sgRNA的编码序列导入细胞,使细胞稳定表达Cas9和sgRNA,实现基因敲除。病毒感染宿主细胞后,外源基因会整合到其基因组中,宿主细胞可长期表达Cas9,使其持续作用于目标基因。
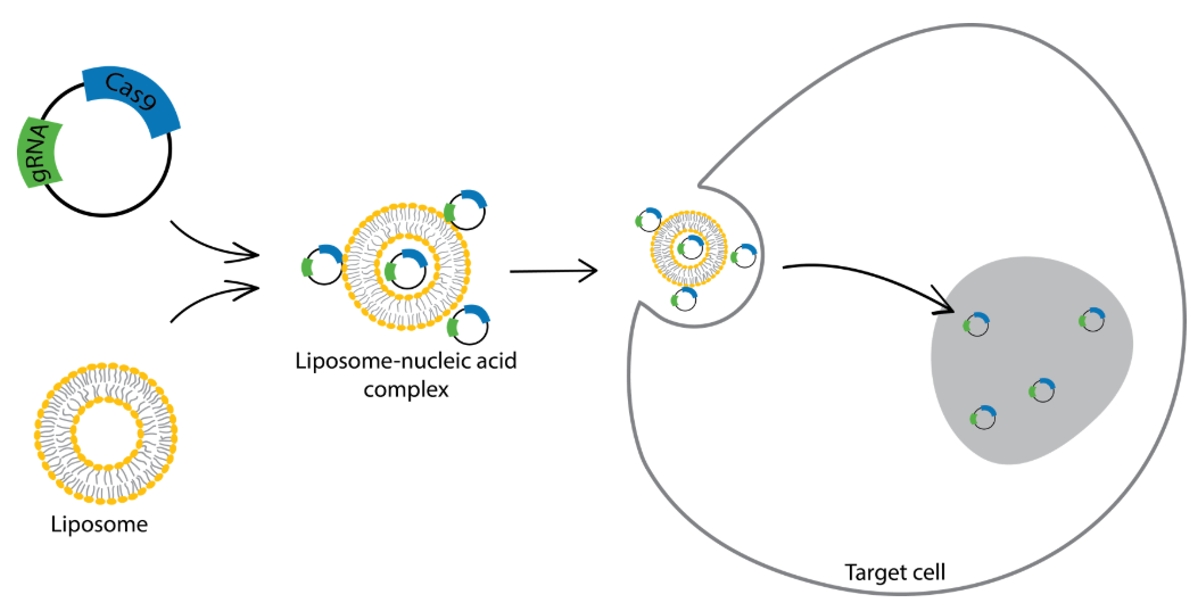
基于CRISPR-Cas9基因编辑技术通过慢病毒转染法构建基因敲除细胞株[2]
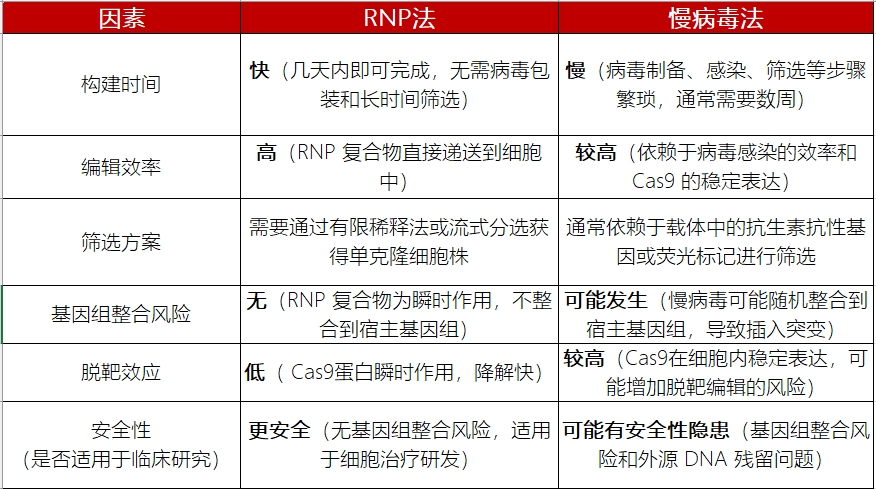
RNP法和慢病毒转染发在编辑效率、操作便捷性、安全性等方面都各有千秋,对于药物研发者而言,选择哪种方案取决于实验目的、细胞类型、时间成本、安全性以及应用场景等因素:
RNP法和慢病毒法在构建基因敲除细胞株时的对比
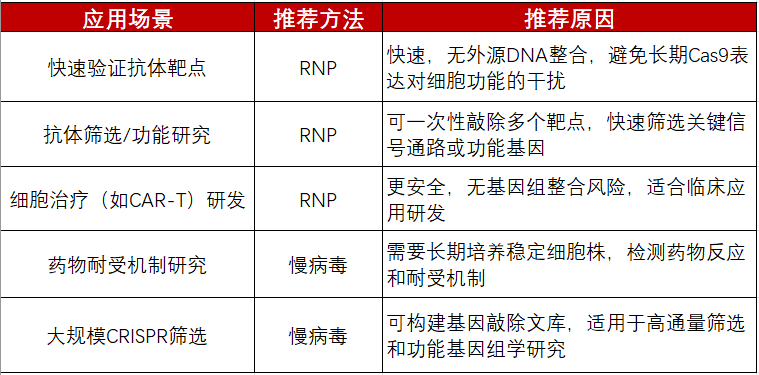
针对不同应用场景的推荐方法和推荐原因
ACROBiosystems百普赛斯基于成熟高效的CRISPR-Cas9基因编辑平台,包括sgRNA设计和验证、基因编辑细胞系开发和基因组测序等完整的技术流程,正在持续开发高质量的基因敲除细胞株产品,并进行严格的质量控制以保证细胞株产品的功能和稳定性,为新药研发提供可靠的细胞水平研发工具!
-
细胞株经严格质量控制,经表达验证(FACS)和基因组测序验证;
-
原始细胞株来源清晰,可追溯完整记录;
-
全程售前售后服务保障;
-
可提供临床申报及 CMC 所需支持文件。
|
分子 |
货号 |
描述 |
|
Raji/Human CD19 Knockout Stable Cell Line Development Service |
更多基因敲除细胞株产品将陆续推出,敬请期待~
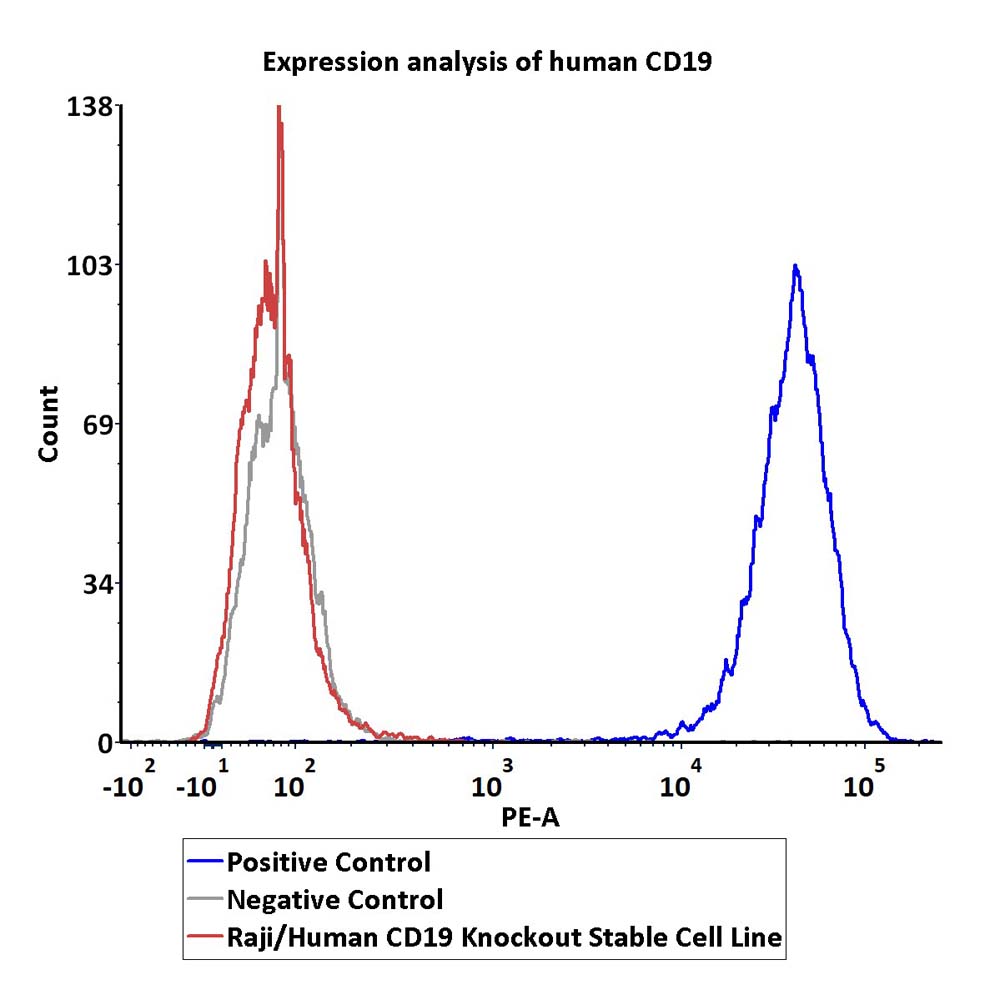
Expression analysis of human CD19 on Raji/Human CD19 Knockout Stable Cell Line by FACS.
Cell surface staining was performed on Raji/Human CD19 Knockout Stable Cell Line using PE-labeled anti-human CD19 antibody. The Raji cells were stained with PE-labeled anti-human CD19 antibody as the positive control cell. The Raji cells were stained with PE-labeled isotype control antibody as the negative control cell.
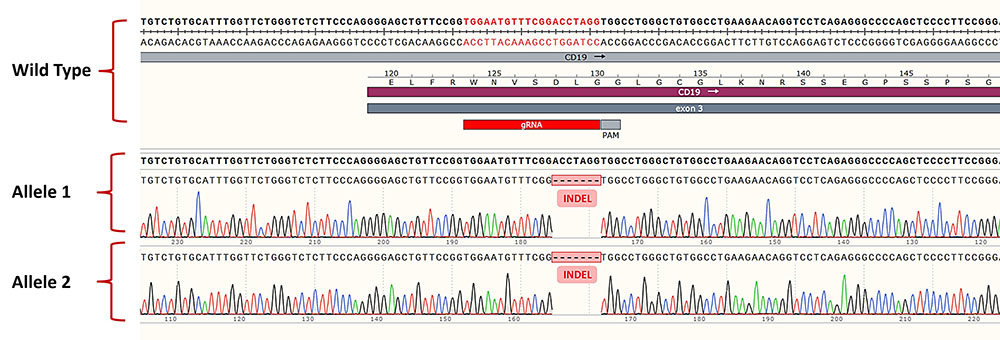
Genomic Sequencing of human CD19 in the Raji/Human CD19 Knockout Stable Cell Line.
基于ACROBiosystems百普赛斯成熟的CRISPR-Cas9基因编辑平台,我们可为您定制特定靶点的基因敲除细胞株!
ACROBiosystems百普赛斯目前已正式获得全球范围内对HEK293、CHO、Jurkat和Raji等细胞株的商业化使用权利,并在全球范围内为客户提供细胞株授权相关支持和服务。
参考文献
1.Zoppo, M., Okoniewski, N., Pantelyushin, S. et al. A ribonucleoprotein transfection strategy for CRISPR/Cas9‐mediated gene editing and single cell cloning in rainbow trout cells. Cell Biosci 11, 103 (2021). https://doi.org/10.1186/s13578-021-00618-0
2.https://www.benchling.com/blog/how-to-express-crispr-in-your-target-cells
3.Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J. A., & Charpentier, E. (2012). A programmable dual-RNA–guided DNA endonuclease in adaptive bacterial immunity. Science, 337(6096), 816-821.
4.Kim, S., Kim, D., Cho, S. W., Kim, J., & Kim, J. S. (2014). Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Research, 24(6), 1012-1019.
5.Charlesworth, C. T., Deshpande, P. S., Dever, D. P., Camarena, J., Lemgart, V. T., Cromer, M. K., ... & Porteus, M. H. (2019). Identification of preexisting adaptive immunity to Cas9 proteins in humans. Nature Medicine, 25(2), 249-254.
6.Staahl, B. T., Benekareddy, M., Coulon-Bainier, C., Banfal, A. A., Floor, S. N., Sabo, J. K., ... & Doudna, J. A. (2017). Efficient genome editing in primary human T cells by CRISPR-Cas9 ribonucleoprotein delivery. Genome Research, 27(3), 515-526.
下一篇: 抗体Fc段亲和力评估详解